
|
Календарь беременности 01-42 Подготовка к беременности Для тех, у кого беременность первая |
|

Подготовка к родам вертикальным и обычным
Папилломавирусная инфекция
—
Папилломавирусная инфекция (ПВИ) – одно из наиболее распространенных и социально значимых заболеваний в мире, поскольку большая часть сексуально активного населения в течение жизни имеет контакт с вирусом папилломы человека (ВПЧ). По данным современных исследований, частота инфицирования ВПЧ в возрастной группе 16–29 лет составляет 45–81%.
В настоящее время известно около 200 различных генотипов ВПЧ, которые обнаруживают в тканях различных патологических образований организма человека, однако более 40 разновидностей ВПЧ выявляются преимущественно в эпителии аногенитальной области. Известно, что у большинства инфицированных ПВИ протекает бессимптомно в транзиторной форме. При этом ВПЧ-индуцированные изменения эпителия носят переходный характер и в 70% случаев разрешаются в течение 1 года, а 90% случаев – в течение 2-х лет благодаря формированию вирус-специфического клеточного и гуморального иммунитета. Однако в ряде случаев вирус не элиминируется, а длительно сохраняется в ткани, и в результате может произойти патологическая трансформация нормального эпителия в диспластический. ВПЧ способен оказывать на эпителиальные клетки-мишени продуктивное или трансформирующее воздействие. Итогом этих процессов становятся как доброкачественные папилломы и кондиломы кожи и слизистых оболочек, так и дисплазии различных степеней тяжести вплоть до злокачественных новообразований.
Частота развития цервикальной внутриэпителиальной неоплазии в 10 раз превышает частоту развития аналогичной патологии во влагалище или вульве. Это связано с тем, что зона трансформации шейки матки имеет специфический риск канцерогенности при ПВИ, поскольку ВПЧ тропен к клеткам в состоянии метаплазии. Важно отметить, что ВПЧ эволюционно выработал различные способы «обхода» иммунологического надзора со стороны макроорганизма, при этом в ряде случаев отмечается хроническое рецидивирующее течение инфекции с возможной малигнизацией процесса. Длительная активация экспрессии вирусных онкогенов инициирует многостадийный процесс генетических и эпигенетических нарушений, способствующих опухолевой прогрессии. Доказано, что папилломавирусная инфекция является ведущей причиной рака шейки матки.
Как показывают исследования, для развития рака шейки матки, помимо персистенции ВПЧ в интегрированной форме, необходимо наличие кофакторов (наличие онкогенного генотипа, сочетание нескольких генотипов вируса, существенная вирусная нагрузка, курение, длительный прием гормональных препаратов, сопутствующие урогенитальные инфекции, снижение неспецифической резистентности организма, влияние генетических факторов и т. д.). Заслуживает внимания тот факт, что рак шейки матки является вторым по распространенности онкологическим заболеванием органов репродуктивной системы в мире. По данным ВОЗ, ежегодно в мире диагностируются около 500 тыс. новых случаев рака шейки матки, из них по меньшей мере половина заканчивается летально. Важным профилактическим мероприятием в отношении цервикальной карциномы становится своевременная диагностика и адекватное лечение заболеваний шейки матки, прежде всего ассоциированных с ВПЧ.
В диагностике ВПЧ-инфекции приоритет отдается использованию молекулярно-биологических методов для обнаружения и идентификации ДНК ВПЧ. Это позволяет не только выявить инфекцию, но и выяснить, сколько генотипов представлено одновременно, какова вирусная нагрузка, а также в какой форме присутствует вирус – в эписомальной или интегрированной. По данным В.Н. Прилепской и соавт., в 58% случаев обнаружения ВПЧ у женщин с различной генитальной патологией присутствуют типы высокого онкогенного риска.
В настоящее время существует мнение, что диагностика, направленная на прогнозирование патологии шейки матки, должна основываться на цитологическом скрининге, подкрепленном ПЦР-диагностикой вируса папилломы человека и внедрением специфических молекулярных маркеров.
Подход к ведению больных с ПВИ гениталий и заболеваниями шейки матки в практической работе врача-гинеколога имеет огромное значение, поскольку неверная тактика может способствовать прогрессированию процесса, появлению различных осложнений, возникновению ятрогенных состояний, существенным материальным затратам и снижению качества жизни пациентки. Стоит отметить, что до сих пор единого общепринятого стандарта лечения пациентов с ВПЧ-ассоциированной инфекцией не существует ввиду наличия множества спорных вопросов по данной проблеме. Предложено большое число методов лечения аномально измененного эпителия шейки матки, а также влагалища и вульвы, однако ни один из них не является универсальным и лишенным недостатков, среди которых вероятность развития рецидивов, формирования анатомо-функциональных нарушений органа, а также неблагоприятное влияние дыма, содержащего вирусные частицы после деструкции инфицированного очага, на лечащего врача.
Выбор тактики лечения ВПЧ-ассоциированных заболеваний должен основываться на правильно установленном диагнозе, особенностях морфологии, локализации и размеров поражений, технических возможностях врача, предпочтениях пациентки и ее репродуктивных планах, наличии сопутствующей патологии и т. д. В последние годы достигнут значительный прогресс и существенно расширились возможности в плане лечения патологии шейки матки как основы профилактики злокачественных поражений данной локализации. При этом стоит отметить, что в целом тактика ведения пациенток стала более щадящей. Из современных технологий деструкции патологических процессов шейки матки аргоноплазменная коагуляция (АПК) является одним из наиболее перспективных, эффективных и безопасных методов.
К сожалению, достичь полного излечения от ПВИ не всегда возможно, в связи с этим общепринятой целью терапии является удаление очага поражения, а не полная элиминация возбудителя, а точнее прекращение выделения его из очагов поражения (учитывая, что методология диагностики заключается в исследовании клеток соскоба, взятого из этих зон). Это обусловлено тем, что вирус находится не только в аномальном эпителии, но и во внешне здоровых тканях по периферии очага. В связи с этим оптимальным стоит считать комплексное лечение, включающее не только локальное воздействие на патологически измененные ткани, но и неспецифическую противовирусную терапию.
Помимо различных методик деструкции арсенал медикаментозных средств лечения может включать в себя антисептики, антибактериальные и противовирусные препараты для ликвидации воспалительного процесса шейки матки и влагалища; гормональные препараты – при сопутствующих нарушениях функции яичников, а также иммуномодуляторы. Известно, что в основе любого хронического инфекционно-воспалительного процесса лежат те или иные изменения в иммунной системе, являющиеся одной из причин существования этого процесса, поэтому локальное и/или системное применение иммунопрепаратов в ряде случаев может использоваться как альтернативное средство лечения при обширных поражениях и/или рецидивирующих процессах как в виде монотерапии, так и в составе комбинированного лечения.
Среди данной группы средств интерес представляет инозина пранобекс (Изопринозин), который является синтетическим производным пурина и обладает иммуномодулирующей активностью и противовирусным действием. Изопринозин оказывает стимулирующее влияние на активность цитотоксических Т-лимфоцитов и естественных киллеров, функции Т-супрессоров и Т-хелперов, повышает продукцию ИЛ-1 и ИЛ-2, снижает образование ИЛ-4 и ИЛ-10, потенцирует хемотаксис нейтрофилов, моноцитов и макрофагов. Кроме того, препарат проявляет выраженную противовирусную активность in vivo в отношении множества известных вирусов, включая ВПЧ. Механизм противовирусного действия Изопринозина связан с ингибированием вирусной РНК и фермента дигидроптероатсинтетазы, участвующего в репликации вирусов, усилении синтеза мРНК лимфоцитов, что сопровождается подавлением биосинтеза вирусной РНК и трансляции вирусных белков, повышает продукцию лимфоцитами обладающих противовирусными свойствами интерферонов – альфа и гамма.
Инозин пранобекс является одним из наиболее изученных системных иммуномодуляторов, он включен в Европейское руководство по лечению бородавок и кондилом, а также в Российский протокол ведения пациенток с ПВИ. Препарат способствует подавлению репликации ВПЧ в эпителиальных клетках и выведению вируса из организма.
По мнению О.А. Мынбаева, оптимальным методом лечения клинической манифестации ВПЧ было бы применение лечебных вакцин, механизм действия которых основан на блокировании вирусных генов или протеинов, необходимых для инфицирования, персистенции и размножения вирионов ВПЧ в эпителиальных клетках, при этом активировалась бы клеточная иммунная реакция, которая элиминировала бы инфицированные клетки эпителия. Этот путь лечения ВПЧ обнадеживающий, но пока идет процесс разработки терапевтических вакцин. Использование данного механизма элиминации вирусов возможно на данном этапе лишь с помощью иммуномодуляции.
В условиях многопрофильного медицинского центра г. Нижнего Новгорода было обследовано и пролечено 65 пациенток репродуктивного возраста с патологией шейки матки на фоне ПВИ: эктропионом и эктопией (с обширной зоной трансформации), CIN легкой степени, плоскими кондиломами, гиперкератозом (лейкоплакией) и стойким, клинически выраженным хроническим цервицитом. Они были равномерно распределены на 2 клинические группы. В 1-ю группу вошли 34 женщины, которым наряду с АПК шейки матки была назначена иммуномодулирующая терапия Изопринозином в дозе 1000 мг 3 р./ сут в течение 10 дней за 2–3 нед. до деструкции и через 2–3 нед. после нее. Ко 2-й группе отнесли 31 пациентку, которым проводилась только АПК шейки матки (контроль). Обе группы были сравнимы по возрасту, характеру менструального цикла, репродуктивному анамнезу и представленной цервикальной патологии.
Целью исследования стала оценка эффективности лечения различных заболеваний шейки матки на фоне ПВИ у женщин репродуктивного возраста на основе анализа ближайших и отдаленных результатов.
Пациенткам проведено стандартное обследование – диагностика ИППП молекулярными методами, в т. ч. определение ВПЧ с вирусной нагрузкой, микроскопическое и микробиологическое исследование, расширенная кольпоскопия, цитологическое исследование мазка, анализ крови на RW, антитела к ВИЧ, HBs-Ag, HCV-Ag, гистологическое исследование биоптата (при атипической цитологической и/или кольпоскопической картине). Во всех случаях присутствовали высокоонкогенные генотипы ВПЧ. При необходимости перед хирургическим вмешательством назначались санация влагалища и противовоспалительная терапия.
Процедуры радиоволновой биопсии и аргоноплазменной коагуляции (аблации) проводились на отечественном аппарате «Фотек ЕА-141» на 5–9-й день менструального цикла. Аблация выполнялась при условии полной кольпоскопической визуализации зоны трансформации и отсутствия расхождения между данными проведенных обследований. Для этого использовался поток аргоновой плазмы в режиме «Спрей» мощностью 36–40 Вт. Осложнений во время процедуры не возникло ни в одном случае. По окончании вмешательства пациентки были отпущены домой с соответствующими рекомендациями по гигиене, образу жизни и приему Изопринозина (в 1-й группе).
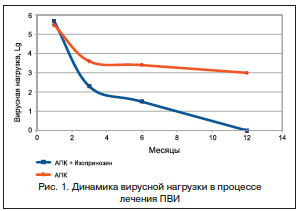
Контрольный осмотр, расширенная кольпоскопия, определение ВПЧ с вирусной нагрузкой проводились через 1,5–2 мес. после операции и далее в динамике через 3–6 и 12 мес. Было установлено, что в группе с комбинированным лечением (АПК и Изопринозин) средняя продолжительность заживления шейки матки после процедуры составила 44±3,2 дня, что сопоставимо со скоростью эпителизации у женщин без ПВИ. В группе контроля в 68,5% случаев имела место вялая замедленная регенерация шеечного эпителия (56±2,4 дня), что, по всей видимости, было обусловлено влиянием активной вирусной инфекции и неадекватной иммунной реакцией тканей. Судя по всему, в подобной ситуации репаративный процесс может замедляться и извращаться, поэтому полноценного разрешения не происходит и нормальная структура тканей не восстанавливается в течение длительного времени.
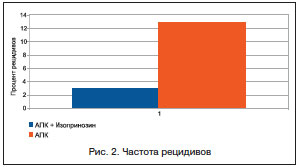
Через 3 и 6 мес. в 1-й группе после комбинированного лечения у 94,1% пациенток по данным цитологического и кольпоскопического исследований существенных изменений на шейке матки выявлено не было. Через 3 мес. отмечен рецидив CIN1 у 1(2,94%) пациентки с гипогонадотропной аменореей и исходно высоким уровнем вирусной нагрузки (>5 Lg (ВПЧ/100 тыс. клеток), в связи с чем потребовался повторный курс лечения. Известно, что гормональный дисбаланс приводит к выраженным нарушениям в дифференцировке клеточных пластов и дистрофии эпителия, что может существенно затруднять лечение. Еще в одном случае мы наблюдали кольпоскопические признаки субэпителиального асимптомного эндометриоза, не требовавшего вмешательства. Что касается обнаружения ВПЧ с помощью метода ПЦР, то выделение вируса из очага прекратилось в 91,2% случаев в течение ближайших 1,5–2 мес.; у остальных пациенток после прогрессивного снижения вирусной нагрузки через 3–6–12 мес. молекулярные маркеры ПВИ также не определялись.
В контрольной группе клиническая эффективность лечения патологии шейки матки с помощью АПК по данным кольпоскопии и цитологии составила 87,1%, при этом прекращение вирусовыделения из очага в течение 3–6 мес. было достигнуто лишь в 61,3% наблюдений. Рецидивы в виде появления йод-негативных зон, мозаики, признаков гиперкератоза и дисплазии по результатам контрольных исследований в данной группе зафиксированы в течение 3–6 мес. у 4 (12,9%) пациенток. Реактивация ПВИ проявлялась не только признаками персистенции вирусной инфекции согласно результатам кольпоскопии, цитологии и детекции ДНК ВПЧ, но и повышением вирусной нагрузки в отсроченном периоде после деструкции аномальной зоны трансформации (рис. 1, 2).
Обсуждая полученные результаты, стоит отметить, что локальная деструкция очагов поражения позволяет воздействовать только на участок эпителия, где произошла клиническая манифестация инфекции, тогда как в окружающих тканях остаются в латентном состоянии резервуары ВПЧ или других возбудителей, которые могут являться основой для дальнейшего рецидива и персистенции инфекции. Учитывая, что во всех случаях у обследованных нами пациенток в качестве этиологических факторов имели место высокоонкогенные генотипы ВПЧ, длительная стойкая персистенция ПВИ могла быть ассоциирована с высокой вероятностью озлокачествления патологического процесса. В связи с этим есть основания полагать, что адекватная иммунотерапия наряду с аблацией шейки матки способствует полноценной санации инфекционного очага и эпителизации, что закономерно снижает частоту рецидивов и повышает эффективность лечения. Изопринозин прямо и косвенно, обладая противовирусным действием и оказывая влияние на противовирусный иммунитет, способен подавлять репликацию ВПЧ и образование вирусных белков. Эти эффекты могут изменять механизм взаимодействия ВПЧ и макроорганизма, препятствуя персистированию вируса, а также влияя на клиническую манифестацию инфекции.
Что касается побочных эффектов в процессе приема Изопринозина, то они наблюдались лишь у 3 из 34 обследованных пациенток, что составило 8,8%. Среди жалоб отмечали тошноту, боли в эпигастрии, кожные аллергические реакции. Однако ни в одном случае побочные эффекты не стали поводом для отмены препарата и самостоятельно нивелировались через несколько дней. В целом отмечена хорошая переносимость Изопринозина, а поскольку серьезные побочные реакции и осложнения не были зарегистрированы, этот факт является отражением высокого профиля безопасности данного иммуномодулятора.
Немаловажен и тот факт, что при использовании технологии АПК не происходит перегрева, дымообразования и обугливания тканей (карбонизации), а отсутствие задымленности способствует хорошей визуализации операционного поля и снижает негативное влияние на врача, производящего процедуру.
Таким образом, результаты проведенного исследования свидетельствуют о высокой эффективности и безопасности сочетания аблативного вмешательства с использованием аргоновой плазмы и назначения иммуномодулирующей терапии Изопринозином. При этом в большинстве случаев достигается адекватная деструкция очага, быстрейшее заживление послеоперационной раны, а также существенно снижается вероятность рецидивирования и малигнизации патологического процесса за счет прекращения выделения ВПЧ. Отдельно стоит отметить важность и необходимость соблюдения рекомендованных курсовых дозировок при назначении Изопринозина для полноценной реализации его лечебного эффекта и во избежание дискредитации метода нарушением использования препарата.
Выводы
Проблема ПВИ далека от окончательного разрешения, и многие вопросы составляют предмет проводимых в настоящее время научных работ. Сложности обусловлены значительной распространенностью инфекции, выявлением новых генотипов ВПЧ и существенными различиями в их злокачественной потенции, изменениями напряженности противовирусного иммунитета организма, который, в конечном счете, определяет стабильность излечения или время наступления рецидива. Накопленные сведения о механизме вирус-индуцированной неоплазии определяют необходимость дальнейших исследований для создания надежных этиопатогенетических схем лечения.
Перспективные диагностические и лечебно-профилактические направления в отношении ПВИ и рака шейки матки включают в себя широкое внедрение в практику метода жидкостной цитологии, оценку клинической значимости концентраций ВПЧ в тканях, дальнейшее изучение роли молекулярных биомаркеров для прогнозирования активности вируса и прогрессирования патологического процесса, разработку и использование профилактических и терапевтических вакцин и высокоэффективных противовирусных препаратов.
Таблицы
Автор: Мотовилова Т.М.
001 =
002 =
003 =
004 =
 005
005
|
||||||||||||
|
| | |||||||||||
|
|