|
Календарь беременности 01-42 Подготовка к беременности Для тех, у кого беременность первая |
|

Подготовка к родам вертикальным и обычным
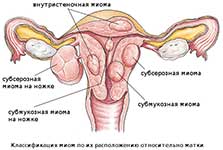
Тактика ведения пациенток с миомой матки от раннего репродуктивного до постменопаузального возраста
—
Миома (лейомиома) матки остается самой часто встречающейся опухолью репродуктивной системы у женщин. Согласно статистике, более 50% от числа всех пациенток отделений оперативной гинекологии составляют женщины с миомой матки. Частота данной патологии колеблется от 25 до 35% у женщин репродуктивного возраста, возрастая до 43–52% у женщин в перименопаузальном возрасте. В настоящее время не является редкостью выявление миоматозных узлов у женщин в 20–30-летнем возрасте.
Миому относят к моноклональной доброкачественной гладкомышечной опухоли, рост которой вызывается комплексом факторов, влияющих на процессы пролиферации, апоптоза и ангиогенеза. Многочисленные исследования, посвященные патогенезу опухолевого роста, показывают, что центральная роль в регуляции роста миомы матки отводится половым стероидам – эстрогенам, прогестерону и их рецепторам – в моделировании роста, дифференцировки и функции миометрия.
Некоторые авторы рассматривают лейомиому матки как местное проявление сложных изменений, происходящих в организме женщины, как болезнь дезадаптации, выражающуюся в нарушении взаимоотношений в системе гипоталамус-гипофиз-яичники-матка со своеобразной гиперплазией миометрия на фоне нарушенных гормональных взаимоотношений и/или измененной рецепторной чувствительности эффекторного органа.
Определенную роль в возникновении лейомиомы матки играет нарушение гемодинамики, иннервации и водно-электролитного баланса, при которых уменьшается эластичность стенок кровеносных сосудов миометрия, возникает стаз, снижается крово- и лимфоотток и коэффициент Na/K, возникает тканевая гипоксия. Это приводит к нарушению дифференциации клеток миометрия, которые приобретают способность к пролиферативному росту, что, в свою очередь, способствует формированию лейомиомы матки даже в условиях сохраненного гормонального статуса.
Е.М. Вихляева считает, что не существует бессимптомной миомы матки. И действительно, если у женщин на начальных стадиях отсутствуют кровотечения, боли, нарушения функции смежных органов, то это не говорит о том, что не будет роста опухоли в скором времени. Считается, что миома – опухоль доброкачественного происхождения, но не следует забывать о том, что может произойти ее злокачественное перерождение в любом возрасте. В настоящее время гинекологи склоняются к мнению, что в репродуктивном возрасте опасность развития онкологического процесса в опухоли наиболее реальна у тех женщин, у которых помимо лейомиомы матки определяются еще 2–3 фактора риска, особенно при наличии метаболических нарушений. В период перименопаузы и менопаузы миома матки является самостоятельным фактором риска, особенно если имеются другие признаки гиперэстрогении или эндокринно-метаболических нарушений. Я.В. Бохман однозначно определял роль миомы матки как маркера злокачественных новообразований. Не зря во многих классификациях миому выделяют как пограничную опухоль, способную к малигнизации.
Многообразие вариантов клинического течения миомы матки, возрастной диапазон от раннего репродуктивного до постменопаузального, частое сочетание с другими гинекологическими заболеваниями диктуют необходимость индивидуального выбора метода лечения этих женщин.
Тактика ведения женщин с миомой матки детородного возраста различна, т. к. во многом зависит от необходимости сохранения репродуктивной функции.
Миома матки не является абсолютным показанием к хирургическому лечению. Пациенток молодого репродуктивного возраста с размерами миомы до 4 см без клинических проявлений можно лечить консервативно с применением низкодозированных оральных контрацептивов.
Однако длительное бездействие и применение гормональных препаратов в лечении миомы матки у женщин, планирующих беременность, может ухудшить состояние репродуктивной функции и повысить риск потери органа за счет денервации, гиперплазии миометрия и разрушения рецепторного аппарата миоцитов. Поэтому консервативное ведение может длиться не более 3 лет с обязательным диспансерным наблюдением.
Хотя беременность и ее благоприятное завершение при миоме матки вполне возможны, у 20% женщин миома является причиной бесплодия. Беременность при миоме матки, роды и послеродовый период нередко имеют осложненное течение и в ряде наблюдений заканчиваются потерей плода и матки. Наиболее частыми гестационными осложнениями в настоящее время являются: угроза прерывания беременности в различные сроки, фетоплацентарная недостаточность и синдром задержки роста плода, неправильное положение и предлежание плода, отслойка плаценты, особенно в тех случаях, когда она частично расположена в области миоматозного узла, быстрый рост опухоли, которые могут развиться в любом сроке гестации. Нередким осложнением беременности при миоме матки является некроз узла, который при лабораторном, клиническом и ультразвуковом подтверждении является абсолютным показанием к хирургическому лечению. Наиболее частыми осложнениями родов и послеродового периода являются: несвоевременное излитие околоплодных вод, аномалии сократительной активности матки, плотное прикрепление плаценты, гипотоническое кровотечение, субинволюция матки, некроз узла.
В связи с вышеизложенным задача акушера-гинеколога на амбулаторном этапе заключается в прогнозировании возможных осложнений беременности при миоме матки у каждой конкретной пациентки и создании условий для благоприятного вынашивания беременности, течения родов и послеродового периода.
Наш многолетний опыт показывает, что репродуктивные исходы у женщин с миомой матки, планирующих беременность, напрямую зависят от своевременно и качественно проведенной прегравидарной подготовки, которая должна включать: топическую диагностику миомы с составлением прогноза ее роста во время беременности; предоперационную подготовку с санацией инфекционных очагов и лечение анемии; своевременную миомэктомию при размерах узлов больше 4–5 см с соблюдением хирургической технологии, обеспечивающей благоприятные условия для формирования полноценного рубца (рубцов) на матке; комплексную послеоперационную реабилитацию.
В настоящее время предложено довольно большое количество дополнительных методов исследований, позволяющих диагностировать миому матки, оценить особенности ее развития, провести дифференциальную диагностику, определить тактику ведения больной и определить наиболее рациональный метод лечения.
Ключевое значение для своевременной диагностики миомы имеет УЗИ, ставшее рутинным в наше время и вошедшее в практику лечебных учреждений. Применение ультразвукового сканирования позволяет с точностью до 97% выявить миому матки, правильно определить количество узлов миомы, их размер, локализацию, отношение узлов к сосудистым пучкам матки, наличие в них дистрофических и некротических изменений. Исследование кровотока в сосудах новообразований, которые имеют свои характерные особенности, позволяет считать цветовое допплеровское картирование (ЦДК) важным методом в дифференциальной диагностике доброкачественных и злокачественных опухолей матки. Зарегистрированный с помощью ЦДК уровень васкуляризации позволяет прогнозировать быстроту роста выявленного образования.
Вопрос о выборе хирургического доступа для миомэктомии по-прежнему остается одним из наиболее дискутабельных. Мы считаем, что открытый абдоминальный и лапароскопический доступы не являются конкурирующими, а каждый из них имеет свои показания и преимущества. Большие интралигаментарные и атипически расположенные узлы миомы, возможность более тщательного послойного сопоставления краев раны при чревосечении и отсутствие коагуляционного некроза тканей при данном методе делают лапаротомию методом выбора доступа при проведении миомэктомии у пациенток, планирующих и не исключающих беременность в дальнейшем.
Показаниями к миомэктомии на этапе планирования беременности являются:
• объем узлов (узла), превышающих половину объема нормальной матки (больше 4 см);
• маточные кровотечения, приводящие к анемизации и обусловленные миомой матки;
• большие и гигантские размеры опухоли (превышающие 12 нед. беременности) даже при отсутствии жалоб;
• опухоли любых размеров при наличии симптомов сдавления соседних органов (учащенное или затрудненное мочеиспускание, нарушение акта дефекации);
• атипичное расположение узлов (шеечная, перешеечная и интралигаментарная локализация узлов миомы матки);
• быстрый рост опухоли;
• нарушение кровообращения в узле;
• наличие субсерозных миоматозных узлов больше 4–5 см;
• бесплодие при наличии миомы матки.
Особенностями хирургической техники являются: внутрикапсульное вылущивание узла миомы; тщательный гемостаз за счет сдавления сосудов тканями; исключение для гемостаза энергетических воздействий; зашивание раны отдельными швами синтетическим длительнорассасывающимся шовным материалом; проведение противоспаечных мероприятий.
Удаление миоматозных узлов можно считать лишь одним из этапов комплексного лечения миомы матки, т. к. рецидивы чаще всего возникают у больных с множественными миоматозными узлами, сочетанной гинекологической патологией, при отсутствии гормональной терапии в послеоперационном периоде.
Послеоперационная реабилитация является важнейшим этапом в прегравидарной подготовке пациенток после миомэктомии. В комплекс реабилитационных послеоперационных мероприятий целесообразно включать гормональную, иммуномодулирующую, противовоспалительную, антианемическую терапию и препараты, улучшающие репаративные процессы в матке.
Нами в качестве гормональной составляющей используются следующие группы препаратов: агонисты гонадотропин-рилизинг-гормона (а-ГнРГ) и комбинированные оральные контрацептивы. Показаниями для назначения гормональной терапии в послеоперационном периоде являются: наличие множественной миомы матки, атипичное расположение узлов, сочетание миомы с аденомиозом или наружно-внутренним эндометриозом, бесплодие, в тех случаях, когда оперативное вмешательство сопровождалось вскрытием полости матки, а также наличие пролиферативно-активной лейомиомы без сопутствующих гинекологических заболеваний.
Для устранения гипоэстрогенных состояний и лучшей переносимости а-ГнРГ на этапе реабилитации после органосохраняющих операций целесообразно назначение изофлавонов красного клевера.
Динамическое УЗИ в сочетании с допплерометрией (через 3 и 6 мес. после операции) позволяет контролировать эффективность проведенной операции и консервативной терапии с учетом оценки течения репаративных процессов и состоятельности рубца на оперированной матке.
После окончания комплексной терапии менструальная функция восстанавливается в первые 1–3 мес.
Планирование беременности разрешается в среднем через 6 мес. после операции с учетом того, что репродуктивная функция повышается сразу после окончания действия гормональной терапии. Для женщин возрастной группы старше 35 лет при отсутствии наступления самопроизвольной беременности в течение полугода после органосохраняющей операции и проведенной гормональной реабилитации целесообразно рекомендовать использование вспомогательных репродуктивных технологий.
Таким образом, прегравидарная подготовка пациенток с миомой матки и репродуктивными проблемами, включающая своевременное и тщательное обследование на этапе планирования беременности, обоснование четких показаний к миомэктомии, проведение комплексной послеоперационной реабилитации, способствует улучшению качества жизни пациенток, повышает частоту наступления беременности и снижает частоту рецидива заболевания.
Пациенткам, реализовавшим свою детородную функцию, но желающим сохранить менструальную, выполняется миомэктомия с последующим применением комбинированных оральных контрацептивов или внутриматочной гормональной системы «Мирена». Даже при достаточно технически сложной хирургической ситуации мы являемся сторонниками проведения органосберегающих операций с последующей реабилитацией у всех пациенток детородного возраста, и только при категорическом отказе пациенток, имеющих детей, от проведения органосберегающей операции расширяем объем до гистерэктомии.
А.Л. Тихомиров и соавт. предлагают двухэтапную схему лечения женщин с симптомной миомой матки размерами от 2 до 4 см. На первом этапе больным назначается курс терапии а-ГнРГ или антигестагенами (мифепристон).
Мифепристон является блокатором рецепторов прогестерона, поэтому оказывает угнетающее влияние на рост миоматозных узлов и приводит к их регрессии. В сыворотке крови больной на фоне приема мифепристона не изменяются уровни эстрогенов и прогестерона, т. е. препарат действует на локальном уровне. Мифепристон не вызывает псевдоменопаузу, что позволяет применять его длительно, не дополняя заместительную терапию эстрогенами. По данным А.Л. Тихомирова и соавт., применение мифепристона в дозе 50 мг/сут в течение 3 мес. позволило уменьшить размеры миоматозных узлов в среднем на 50–60%. Если ограничиться только первым этапом лечения, то полученный эффект может быть недостаточным в связи с большой вероятностью последующего роста узлов. В связи с этим исследователи рекомендуют на втором этапе лечения больным назначать стабилизирующую терапию в виде комбинированных оральных контрацептивов или внутриматочной гормональной системы «Мирена». Рекомендуемая двухэтапная схема лечения патогенетически обоснованна. Понятно, что при миомах матки более 12 нед. беременности и маточных кровотечениях гормонотерапия малоэффективна.
Перименопаузальный период характеризуется глубокой возрастной перестройкой всего женского организма, в т. ч. нейроэндокринной системы, на фоне прогрессирующего угасания функции яичников. Возрастное снижение уровня секреции эстрогенов и прогестерона в постменопаузе не свидетельствует о полном прекращении функции яичников – гормоны в женском организме претерпевают качественные изменения.
С наступлением менопаузы лейомиома матки в 85–90% случаев может регрессировать, особенно при небольших размерах и интерстициально-субсерозной локализации узлов.
Нерегрессирующая миома матки в постменопаузе может служить своеобразным опухолевым маркером по возникновению онкозаболеваний в репродуктивной системе: в эндометрии, миометрии и яичниках.
Считается, что лейомиому матки следует относить к числу факторов риска по развитию атипической гиперплазии эндометрия и рака тела матки, причем вероятность возникновения последних нарастает по мере увеличения длительности существования опухоли и возраста больных.
После 45 лет миома матки часто сочетается с другими гинекологическими заболеваниями, и в силу высокого онкологического риска необходимо проводить обследование на онкомаркеры, расширенную кольпоскопию, цитологическое исследование мазков из цервикального канала и влагалищной части шейки матки на наличие атипичных клеток, раздельное диагностическое выскабливание или аспирационную биопсию эндометрия с последующим гистологическим исследованием. Вследствие часто встречающейся атрезии цервикального канала у женщин в постменопаузе выполнить раздельное диагностическое выскабливание сложно, бесспорный приоритет принадлежит ультразвуковому сканированию.
Важное значение придают определению величины переднезаднего размера М-эха, учитывая наибольшую прогностическую ценность данного критерия при патологических состояниях эндометрия. Ультразвуковое изображение миоматозных узлов в период постменопаузы зависит от вида морфологических процессов, происходящих в нем: фиброз – разрастание соединительной ткани и облитерация сосудов; или некроз – нарушение питания в узле и, соответственно, нарушения крово- и лимфообращения; или процессы пролиферации. При ЦДК чаще видны сосуды, располагающиеся по периферии миоматозного узла. В наружной трети толщи миоматозного узла визуализируются расширенные вены, а сосуды, локализующиеся по наружному контуру узла, чаще представлены артериями. В центральной части узлов сосуды визуализируются значительно реже. Выявление интенсивного внутриопухолевого кровотока миоматозного узла в период постменопаузы позволяет выявить группу больных с признаками пролиферации в миоматозных узлах, злокачественного перерождения узла.
Если женщина вступает в постменопаузу с большими размерами опухоли, высокой эстрогенной насыщенностью, явлениями патологии шейки матки, то, без сомнения, ей требуется оперативное вмешательство в объеме пангистерэктомии. В перименопаузе вопрос об удалении придатков решается индивидуально в зависимости от состояния яичников.
Показаниями к операции являются:
• большие размеры миомы матки с симптомом кровотечения;
• аденокарцинома эндометрия;
• множественная миома матки с болевым симптомом;
• миома матки с симптомом сдавления смежных органов и нарушением их функции;
• атипичное расположение миоматозных узлов;
• сочетание миомы матки с опухолями придатков, гиперплазией эндометрия, наружно-внутренним эндометриозом;
• повторное развитие симптомов заболевания после консервативного лечения и частых раздельно-диагностических выскабливаний.
Для женщин, у которых наблюдаются пременопаузальные расстройства менструального цикла, т. е. для тех, кто стоит на пороге менопаузы, в данной клинической ситуации возможно длительное назначение а-ГнРГ или мифепристона с целью перевода этих больных из искусственной менопаузы в естественную. При отсутствии сопутствующих гинекологических заболеваний, небольших размерах опухоли (до 4 см) и отсутствии симптоматики миомы пациентки в лечении не нуждаются и могут находиться под динамическим наблюдением.
Таким образом, единой тактики ведения пациенток с миомой матки не существует, выбор метода лечения должен быть индивидуальным и во многом определяется возрастом, состоянием преморбидного фона, клиническими проявлениями заболевания, риском развития онкологического процесса и особенностями морфогенеза опухоли.
Таблицы

Автор: Буянова С.Н., Юдина Н.В., Гукасян С.А., Шеина Е.Н.
001 =
002 =
003 =
004 =
 005
005
|
||||||||||||
|
| | |||||||||||
|
|